摘 要: 目的:研究盆腔炎颗粒对混合菌加机械刺激所致大鼠慢性盆腔炎的抗炎抗粘连作用机理。方法:以混合细菌加机械刺激法复制大鼠慢性盆腔炎模型,随机分为正常组、模型组、假手术组、盆炎净组及盆腔炎颗粒大、中、小剂量组,造模2周后,各治疗组灌胃给药2周,以酶联免疫吸附法检测各组大鼠血清IL-1β、IL-10、IL-8、MCP-1的浓度。结果:盆腔炎颗粒可以显著降低模型大鼠血清IL-1β、IL-8、MCP-1水平,并显著升高血清IL-10水平,且大、中剂量组接近正常组水平。结论:盆腔炎颗粒对模型大鼠的抗炎抗粘连作用的机理可能是降低血清前炎症因子及趋化因子水平,同时升高抗炎症因子水平,从而恢复炎症因子平衡,减轻局部炎症反应和纤维增生。 山东中医药大学附属医院妇科刘瑞芬
关键词: 盆腔炎颗粒;慢性盆腔炎;炎症细胞因子;趋化因子
慢性盆腔炎是 妇科常见病 、多发病,临床以腹痛、带下、盆腔组织增厚、粘连、包块形成为主要特征,常常反复发作,缠绵难愈,其防治已成为妇科领域迄待解决的重要课题。盆腔炎颗粒是临床应用疗效肯定的药物,本研究在前期实验研究基础上,观察了盆腔炎颗粒对模型大鼠血清炎症细胞因子和趋化因子的影响,借此探讨活血补肾法抗炎及抗黏连的部分作用机制。
1 材料与方法
1. 1实验动物
健康雌性未交配的SD大鼠70只。体重180~220g,山东大学动物实验中心提供,许可证号: SCXK鲁20030004。
1. 2实验药物
盆腔炎颗粒(丹参、赤芍、菟丝子、生蒲黄、炒五灵脂、连翘等),由山东中医药大学附属医院制剂室提供;盆炎净颗粒(忍冬藤、鸡血藤、益母草、川芎、狗脊等),由昆明积大制药有限公司生产,生产批号:国药准字Z20013124,批准文号: ZZ-4368-滇药准字(1996)第003301号。
1. 3实验试剂
菌种:大肠杆菌、金黄色葡萄球菌、乙型溶血性链球菌以2∶1∶1的比例溶于无菌生理盐水配成浓度为15×10 9 /mL的混合细菌悬液,由山东省卫生防疫站菌种室提供。白介素-1β(IL-1β)、白介素-8(IL-8)、白介素-10(IL-10),单核细胞趋化蛋白-1(MCP-1)酶免试剂盒购自美国ADL公司。
1. 4实验方法
1. 4. 1模型复制 大鼠适应性饲养3天后,于第4天以混合细菌注射法造模。戊巴比妥钠(浓度为0. 4% )腹腔注射麻醉大鼠(50mg/kg)后,无菌条件下,取大鼠下腹正中切口约0. 8~1cm,开腹后暴露并固定子宫,用1mL注射器抽取0. 2mL混合细菌悬液,在注入菌液之前用注射器机械损伤子宫内膜组织,然后注入菌液至双侧子宫内,缝合切口。假手术组麻醉后开腹,双侧子宫内各注射0. 1mL无菌注射用水后关腹。
1. 4. 2分组及给药 从65只大鼠中随机抽取8只为正常组,其余52只参加造模,其中随机抽取8只为假手术组。造模过程中因麻醉过量等原因死亡6只,剩余大鼠造模后饲养14天,进行分组,随机分为模型组、盆腔炎高剂量组、盆腔炎中剂量组、盆腔炎低剂量组、盆炎净组。造模后饲养2周,开始给药。治疗组分别给予盆腔炎颗粒配制液(100mg/mL),高剂量组大鼠2g/kg,中剂量组大鼠1g/kg、低剂量组大鼠0. 5g/kg;盆炎净组给予盆炎净颗粒配制液(54mg/mL)灌胃,每只大鼠540mg/kg。模型组给予2mL的生理盐水灌胃,正常组正常饲养,不给任何处理。每日1次,连续给药14天。
1. 4. 3 指标检测 末次用药24h后,固定动物,心脏取血3~4mL,离心(3000r/min) 10min取上清液分装,置于-30℃以下保存备用。血清中细胞因子IL-1、IL-8、IL-10及MCP-1浓度检测采用酶联免疫吸附法,严格按照试剂盒操作说明书进行。脱颈处死大鼠,肉眼观察各组子宫大体变化,摘取双侧子宫,置10%福尔马林固定液中固定、常规切片、HE染色、光镜下观察子宫组织病理形态变化。
1. 4. 4统计方法 结果用SPSS 16. 0软件进行统计,采用单因素方差分析,各组间比较采用q检验。
2 结 果
2. 1 盆腔炎颗粒对模型大鼠血清IL-1βIL-10水平的影响
实验结果显示,模型大鼠IL-1β水平较正常组显著上升(P<0. 01),而IL-10水平显著下降(P<0. 01)。盆腔炎颗粒各剂量组均可不同程度地降低IL-1β水平,升高IL-10水平,且中、大剂量组接近正常水平(P>0. 05)。盆腔炎颗粒大剂量组IL-1β水平较盆炎净颗粒组显著降低(P<0. 05)。见表1。
表1盆腔炎颗粒对模型大鼠血清IL-1β IL-10水平的影响(pg/mL, 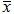 ±s)
±s)
| 组别 | n | IL-1β | IL-10 |
| 正常对照组 | 8 | 35.73±4.43?? | 42.43±4.48? ? |
| 模型组 | 8 | 45.88±4.93※※ | 27.35±2.99※※ |
| 假手术组 | 8 | 36.43±3.74?? | 41.23±4.68? ? |
| 盆炎净组 | 8 | 41.01±3.69? ?※ | 36.75±3.87? ? |
| 盆腔炎大剂量组 | 9 | 36.49±3.09? ?△ | 39.32±4.00? ? |
| 盆腔炎中剂量组 | 9 | 38.82±2.44? ? | 39.97±3.81? ? |
| 盆腔炎小剂量组 | 9 | 40.58±3.61?※ | 35.71±3.72※※?? |
注:与正常对照组比较,※P<0. 05,※※P<0. 01;与模型组比较,?P<0. 05,? ?P<0. 01;与盆炎净组比较,△P<0. 05,△△P<0. 01;下同。
2.2 盆腔炎颗粒对模型大鼠血清IL-8MCP-1水平的影响
实验结果显示,模型大鼠IL-8和MCP-1水平均较正常组显著升高(P<0. 01),盆腔炎颗粒各剂量组均可不同程度地降低IL-8、MCP-1水平,中、大剂量组接近正常水平(P>0. 05),作用程度与剂量相关。盆腔炎颗粒中、大剂量组IL-8、MCP-1水平较盆炎净颗粒组显著降低(P<0. 05或P<0. 01)。见表2。
表2盆腔炎颗粒对模型大鼠血清IL-8 MCP-1水平的影响(pg/mL, 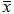 ±s)
±s)
| 组别 | n | IL-8 | MCP-1 |
| 正常对照组 | 8 | 22.47±1.96? ? | 19.04±1.89? ? |
| 模型组 | 8 | 31.50±2.67※※ | 26.05±2.27※※ |
| 假手术组 | 8 | 22.57±2.98? ? | 18.08±1.82? ? |
| 盆炎净组 | 8 | 25.87±2.45? ?※ | 22.90±2.02? ?※※ |
| 盆腔炎大剂量组 | 9 | 21.14±2.96? ?△△ | 20.66±1.66? ?△ |
| 盆腔炎中剂量组 | 9 | 23.22±2.11? ?△ | 21.63±1.68? ? |
| 盆腔炎小剂量组 | 9 | 27.00±3.32※※? ? | 24.37±2.07※※ |
注:与正常对照组比较,※P<0. 05,※※P<0. 01;与模型组比较,?P<0. 05,? ?P<0. 01;与盆炎净组比较,△P<0. 05,△△P<0. 01;下同。
3 讨 论
已有研究认为,部分慢性盆腔炎在慢性发展过程中已经无病原体的存在,慢性阶段的病理改变是继细菌 感染 后的免疫反应所致 [1] ,与免疫因素如相关细胞因子、炎性介质、自由基及细胞凋亡等因素的异常改变有关。炎症细胞因子因其功能可被分为两大类:前炎症细胞因子如白介素-1, IL-8,肿瘤坏死因子-α等;抗炎症细胞因子如白介素-4、IL-10、转化生长因子-β等。前炎症细胞因子可以促进炎症的发展,而抗炎症细胞因子可抑制炎症反应及促进组织的修复和再生。两者的平衡将影响组织创伤及炎症的发展和结局。
细胞因子本是机体正常防御反应的重要参与成分,但当刺激过于强烈,细胞因子产生过度时,它们又可产生广泛的损伤作用。IL-1是一种单核因子,是巨噬细胞分泌的主要细胞因子之一,是炎症发动因子之一。IL-1分为IL-1α、IL-1β,大多数刺激剂刺激条件下, IL-1βmRNA水平要高于IL-1αmRNA数倍。IL-1β能通过激活中性粒细胞和内皮细胞等进一步促进炎性因子的释放,并产生氧自由基、蛋白酶、花生四烯酸等代谢产物,形成级联式瀑布效应,致使内皮细胞受损 [2] 。
单核趋化蛋白-1(MCP-1)和IL-8既是趋化因子,也是前炎症因子。MCP-1属于C-C类趋化因子,主要趋化单核细胞和T淋巴细胞,诱导单核细胞、内皮细胞表达黏附分子,使各种炎性细胞尤其是单核细胞向病变部位聚集 [3] 。IL-8是一种很强的中性粒细胞趋化因子,属于C-X-C类趋化因子,它能促进中性粒细胞的溶酶体及超氧阴粒子、白三烯及5羟色胺的释放,通过增加单核细胞黏附分子的表达,增强其游走能力;同时IL-8又是一种前炎症因子,中性粒细胞与IL-8接触后发生形态变化,定向游走到反应部位并释放一系列活性产物,导致机体局部炎症反应,达到杀菌和损伤细胞的目的 [4] 。
IL-10是一类非常重要的内源性抗炎因子,主要由T细胞产生,是炎症负反馈调节环中的关键成员,具有减轻炎症细胞过度活化状态的作用,在促炎因子激活的同时, IL-10也被激活,并广泛抑制多种促炎细胞因子如TNF-a、IL-1β、IL-6等的合成 [4] 。IL-10能够抑制单核细胞依赖性Th 细胞增生 ,并抑制Th1类细胞因子的合成及其活性,尤其抑制干扰素(IFN-γ)的产生。有研究发现IL-10下调炎症因子表达的作用是通过抑制IκB激酶的活性、削弱核因子κB(NF-κB)与DNA特定位点的结合能力等环节实现的 [5] 。
此外,这些炎症因子也和纤维化和粘连形成有着密切的关系。IL-1对内皮细胞的血管形成活性、成纤维细胞的增殖和胶原合成都有广泛的作用;创伤后IL-1释放并与受体结合,通过自分泌及旁分泌方式,促进表皮细胞、成纤维细胞的增殖与胶原合成 [6] 。IL-8可调节子宫内膜基质细胞基质金属蛋白酶(MMPs)的活性。Mulayim等研究认为, IL-8可增加体外培养的子宫内膜基质细胞(ESC)的MMPs的活性并增加其侵袭能力。IL-8还可以诱导子宫内膜细胞与纤维连接蛋白的黏附,而子宫内膜细胞与纤维连接蛋白和胶原蛋白的黏附又可以诱导IL-8的表达,这两者互相促进,进一步促进腹腔炎症的发展 [7] 。而IL-l0能抑制纤维化过程的进展,其机制可能为IL-10不足时可上调I型胶原的合成并促进胶原蛋白酶基因表达重构细胞外基质,亦可使促纤维化因子TGF-β的产生无法有效抑制等相关 [8] 。
盆腔炎颗粒是治疗慢性盆腔炎的有效药物,根据中医“久病多瘀”、“久病及肾”的理论,以活血化瘀,补肾培元立法,临床用于治疗血瘀肾虚型患者疗效显著,前期研究已表明本药物可改善患者体液免疫及细胞免疫 [9] 。本实验结果显示盆腔炎大鼠IL-1β、IL-8、MCP-1水平显著高于正常组, IL-10水平显著低于正常组,表明在慢性盆腔炎病理过程中,前炎症因子和抗炎症因子之间的平衡被打破,前炎症因子包括趋化因子产生过量,同时缺乏抗炎症因子作用的对抗,导致炎症不断发展引起组织的损伤和纤维增生,而盆腔炎颗粒各剂量组则不同程度地降低了前炎症因子及趋化因子的水平,并升高了抗炎症因子IL-10的水平,并使各炎症因子接近正常水平,即重新恢复了前炎症因子和抗炎症因子之间的平衡,从而减轻局部炎症反应和纤维增生。由此推断盆腔炎颗粒可能是通过使失衡的炎症因子网络恢复平衡而发挥其抗炎及抗粘连作用的,这也可能是活血补肾法治疗本病的部分作用机制。
参考文献 (略)
医学博士 宗惠整理























 打开APP
打开APP